LA CHIMIE FACILE...
Par Eric Naud (AFM)
A la demande générale, et bien que n'étant pas forcément le plus compétent en la matière (e dirai même "et de loin"), j'ai accepté de vous préparer quelques petits cours de chimie. L'objectif n'est pas de faire de vous des prix Nobel, mais simplement d'essayer de donner à chacun les bases indispensables à la pratique d'une minéralogie un tant soit peu scientifique. Notre passion est en effet, d'abord et avant toute chose, de la chimie, c'est-à-dire l'étude de l'agencement et des combinaisons de la matière en fonction de son environnement.
Exemple simple: la rouille, formée à température et pression ambiantes, semble n'avoir que peu de points communs avec les splendides cristaux d'hématite des fentes alpines, ayant poussé à des températures et sous des pressions nettement plus élevées. Il s'agit pourtant dans les deux cas d'une combinaison des mêmes atomes de fer et d'oxygène. Du minéral le plus rare de votre collection au plus minable morceau de ballast de voie ferrée, tout est chimie, et la chimie explique toutes les différences entre ces deux cailloux, de même qu'elle explique pourquoi un Graves n'a pas le même goût qu'un Gigondas, et est (en général) meilleur qu'un "Vin de Différents Pavs de la Communauté Economique Européenne". Mais ceci est une autre histoire.
Mes petits exposés correspondront à peu de choses près au programme qui était en vigueur en classe de 2e C il y a une dizaine d'années. J'essayerai de ne pas trop aborder des sujets dont vous n'aurez pas l'utilité pour votre passe-temps préféré, mais ce ne sera pas toujours facile. A l'inverse, prenez garde de ne pas considérer comme superflues certaines notions fondamentales, même si elles vous semblent un peu rébarbatives au départ. Vous pourrez compléter utilement ces articles en vous procurant un manuel de chimie d'occasion, dans une librairie du Quartier Latin pour les parisiens, et chez tout bouquiniste digne de ce nom pour les autres.
J'ai trouvé ainsi un ouvrage tout à fait complet, et en plus je peux lui faire de la pub car il n'est plus édité:
"Initiation à la chimie moderne" (classe de 2e) Collection A. Cros,
Librairie Eugène Belin. Auteurs: C. Moreau, B. et L. Praud
A défaut, et pour autant que je me rappelle, celui des éditions Cessac et Tréherne était très bien lui aussi.
A la fin de ces petites leçons, vous devriez tous avoir compris pourquoi tels minéraux se forment dans tel type de gisement, comment ils s'altèrent, comment pratiquer quelques petits essais en éprouvette, et surtout, comment déchiffrer les formules chimiques. Donc, je commence.
Leçon n°1 : LES ATOMES
L'atome est la particule élémentaire, la brique dont sont constitués non seulement notre planète et toutes les bestioles qui s'agitent à sa surface, mais également tout le reste de l'univers, et vous aussi par la même occasion. Le sujet devrait donc logiquement vous intéresser.
En fait, ce préambule n'est pas tout à fait vrai (ça commence bien l!!). Il existe d'autres types de particules, mais on les rencontre en général dans des milieux assez peu conviviaux comme par exemple les réacteurs de fusion nucléaire, les accélérateurs de particules, les étoiles, ou encore les trous noirs. Je considère ceci comme hors-sujet et m'en tiendrai donc à ma définition largement suffisante pour l'usage que nous allons en faire.
Les atomes sont des particules de très petite taille. Pour essayer d'appréhender cet ordre de grandeur, on pourra considérer qu'un gramme de carbone, occupant un volume d'environ 0.4 cm³ est constitué de 602 300 000 000 000 000 000 000 atomes.
Quant au diamètre d'un atome, il est de l'ordre de 1 à 2 Angströms.
(1 Å= 1/10 000 000ème de millimètre).
Vous avez du mal à visualiser ces données?
C'est normal. Rassurez vous, vous n'en aurez pas l'utilité, à moins de devenir vraiment très calé en la matière. On a cru pendant longtemps que l'atome était une unité ultime, incassable et indivisible. En fait, on a découvert qu'il est constitué lui même de particules encore plus petites, baptisées proton, électron et neutron, et organisées selon le schéma ci-dessous.
l) un noyau
2) des électrons tournant autour du noyau
1) Le noyau:
Il est composé de protons et de neutrons agglutinés ensemble. Ces deux particules ont des masses quasiment équivalentes, mais le proton a une charge électrique positive alors que le neutron, comme son nom l'indique, est neutre, c'est-à-dire qu'il n'est pas chargé électriquement.
Règle de base: C'est le nombre de protons contenus dans le noyau d'un atome qui détermine l'élément auquel celui-ci appartient. Exemple: l'atome de carbone, qu'il soit sous la forme de graphite, de diamant, ou inclus dans un bout de plastique quelconque, a toujours six protons dans son noyau. S'il y en avait cinq ou sept, ce ne serait plus du carbone, mais respectivement du bore ou de l'azote. Ce nombre de protons est appelé n° atomique de l'élément.
Par contre, pour les atomes d'un élément donné, le nombre de neutrons est variable, tout en restant sensiblement voisin du nombre de protons. Exemple: Dans la nature, le noyau de l'atome de carbone peut contenir 6, 7, ou 8 neutrons, en plus des 6 protons.Ces différents types d'atomes d'un même élément sont appelés des isotopes, et sont nommés en fonction de la somme des protons et des neutrons contenus dans leur noyau. On parlera ainsi dans le cas ci-dessus de carbone 12, de carbone 13, et de carbone 14. Ce dernier doit théoriquement éveiller en vous de vagues souvenirs concernant les datations archéologiques, mais on verra ça plus tard.
2) Les électrons:
Règle de base: dans n'importe quel atome à l'état normal le nombre d'électrons est égal au nombre de protons.
Les électrons tournent à très grande vitesse autour du noyau selon des orbites. Ils sont extrêmement petits, et leur masse est infime, et très souvent négligée dans les calculs (environ 1/2000ème de la masse du proton). Ils sont en revanche porteurs d'une charge électrique de même valeur que celle du proton, mais négative.
S'il faut mettre en œuvre une technologie sophistiquée pour arracher ou ajouter un proton à un atome, celui-ci peut par contre céder ou capter beaucoup plus facilement un ou plusieurs électrons, selon des règles précises que nous verrons plus tard.
Exemple: le fer (symbole chimique Fe, n° atomique 26) peut dans certains cas céder deux électrons. Ce faisant, il se crée un déséquilibre entre le noyau, contenant toujours 26 charges positives (protons), et la couronne électronique, maintenant constituée de seulement 24 électrons. Il y a donc un déficit de deux charges négatives, ou, si l'on préfère, un excédent de deux charges positives.
Ceci explique pourquoi vous pouvez parfois dans les formules chimiques du Fleischer des signes mystérieux, comme Fe2+ dans le cas présent. Selon le même principe, si le fer avait cédé trois électrons, on aurait écrit Fer3+.
A l'inverse, le chlore (symbole Cl) gagne très facilement un électron. Il y aura alors une charge négative en excès, et on écrira donc Cl- .
Ces atomes en état de déséquilibre électrique sont appelés des ions, mais on verra ça plus tard.
3) Structure de la couronne électronique:
Comme je l'ai dit tout à l’heure, les électrons tournent autour du noyau selon des "orbites" relativement imprécises, appelées "couche électronique". Chaque niveau ne peut contenir plus d'un certain nombre d'électrons, ce nombre allant en augmentant quand on s'éloigne du noyau (1er niveau, 2 électrons maximum; 2ème niveau, 8 électrons maximum, 3ème niveau, 18 électrons...). Il ne peut y avoir d'électrons sur un niveau donné si tous les niveaux en dessous ne sont pas complets. C'est par le niveau électronique extérieur que les atomes se lient entre eux pour constituer des molécules. (Paragraphe ardu mais important, à relire jusqu'à assimilation complète).
Deux règles de base:
a) Les propriétés chimiques d'un élément dépendent directement du nombre d'électrons présents sur la couche électronique externe.
b) Deux éléments ayant le même nombre d'électrons sur leur niveau extérieur auront des propriétés chimiques similaires.
Pas de panique, toutes ces notions seront elles aussi détaillées ultérieurement.
Remarques sur les forces électrostatiques:
Au cas où vous ne le sauriez pas (il n'y a pas de honte), deux charges électriques de même signe se repoussent, tandis que deux charges électriques de signes opposés s'attirent. C'est la "force électrostatique".
En toute logique, les électrons devraient donc venir se coller aux protons du noyau, et n'en plus bouger. S'ils ne le font pas, c'est à cause de leur très grande vitesse de rotation, la force centrifuge engendrée compensant ainsi l'attraction électrique. (C'est une notion contre laquelle se battent les professeurs de physiques) On peut illustrer ce phénomène par l'exemple des satellites artificiels, tournant autour de la terre à plus de 20 000 km/h. Si le satellite avait une vitesse nulle, l'attraction terrestre le ramènerait en quelques minutes au niveau du plancher des vaches, où il s'écraserait lamentablement. De même, si la terre ne l'attirait pas, il ne pourrait pas tourner autour, la vitesse acquise lors du lancement l'envoyant se perdre dans les sombres profondeurs de l'espace. Le rôle des techniciens consiste donc à calculer quelle vitesse ils doivent donner au satellite, afin que l'équilibre entre force d'attraction et force centrifuge soit impeccable.
L'atome, lui, réalise cet équilibre naturellement. C'est assez surprenant mais c'est comme ça et ne me demandez pas pourquoi, on ne peut pas tout savoir. Un esprit attentif aura cependant remarqué que selon la logique inverse, le noyau atomique devrait éclater, étant lui même composé de charges positives se repoussant mutuellement. S'il ne le fait pas, c'est qu'il existe en son sein une force de cohésion interne, appelée "interaction forte", et supérieure à la force de répulsion électrostatique. Son étude est hors de propos ici, ce qui me donne un bon alibi car je serais bien incapable d'aligner trois mots sur le sujet. Je vous signale son existence simplement pour vous rassurer.
Propriétés des particules constituant l'atome :
|
Particule |
Masse |
Charge électrique |
|
Proton |
1 u.m.a. (*) |
+ 1 e.v. (*) |
|
Neutron |
1 u.m.a. (*) |
0 |
|
Electron |
0 |
- 1 e.v. (*) |
(*) u.m.a: Unité de masse Atomique
e.v. : Electron Volt
Leçon n°2 : LES ELEMENTS
Rappel:
Revoyons d'abord cinq règles de base étudiées lors de la leçon précédente, et que vous n'avez sûrement pas déjà oubliées:
1) Dans un atome à l'état normal, le nombre d'électrons est toujours égal au nombre de protons du noyau.
2) Le nombre de protons dans le noyau d'un atome détermine à quel élément il appartient.
3) Les électrons tournent autour du noyau à des "distances" relativement précises de celui-ci, appelées "niveaux d'énergie". Chaque niveau d'énergie ne peut contenir plus d'un certain nombre d'électrons.
4) C'est en général, le nombre d'électrons sur le niveau d'énergie le plus éloigné du noyau qui conditionne la plupart des propriétés chimiques de l'élément.
5) Des atomes d'éléments différents, mais ayant le même nombre d'électrons sur leur niveau d'énergie externe, auront des propriétés chimiques voisines.
Tout le monde s'en rappelait? Vous êtes très forts. Je continue.
2) Caractérisation des éléments:
De même que pour les minéraux, l'étymologie des noms des éléments peut dériver de racines antiques comme le grec (chrome, hydrogène) ou le latin (calcium), ou plus contemporaines comme par exemple l'allemand (wolfram). Les éléments peuvent aussi avoir été dédiés à des savants (curium, fermium), à des pays (polonium, américium), ou à des corps célestes (sélénium, hélium).
Chaque élément est représenté par un symbole chimique, composé de une ou deux lettres maximum, et dérivant de son étymologie. Dans un symbole composé de deux lettres, la première est toujours une majuscule, la seconde sera écrite en minuscule. Certains sont faciles à mémoriser (Cu = cuivre ; Fe = fer; O = oxygène ; Si = silicium,...), mais d'autres ont été attribués d'après leurs noms latins (Hg = mercure, anciennement hydrargyrum; Au = or, aurum en latin) ou allemands (W= tungstène, wolfram en allemand).
Ce sont ces symboles, universels, qui seront utilisés pour écrire à la fois les formules chimiques des minéraux et de tous les autres corps, et les réactions se produisant entre eux.
Comme nous avons déjà eu l'occasion de le dire, chaque élément est défini uniquement par 1e nombre de protons de son noyau, à l'exclusion de tout autre critère. Ce nombre est appelé "numéro atomique de l'élément". Il indique le nombre de charges électriques de l'atome, et il est symbolisé par la lettre Z.
Exemple: le noyau de l'atome de calcium contenant 20 protons, Z=20.
Si l'on veut caractériser l'isotope de l'élément auquel on a affaire, il faudra accoler à ce symbole le nombre total des masses présentes dans le noyau, c'est à dire la somme (protons + neutrons) (voir leçon 1). Ainsi pour le carbone, on écrira 12C, 13C, ou 14C, selon que le noyau contient 6, 7, ou 8 neutrons en plus des 6 protons. Mais on verra ça plus en détails ultérieurement.
Le nombre de masses (protons + neutrons) détermine une valeur appelée "masse atomique de l'élément". Cette grandeur n'est pas toujours un nombre entier, car elle tient compte du pourcentage des différents isotopes présents dans l'élément à l'état naturel.
C'est un peu confus, mais avec un petit exemple, ça devrait passer:
Le cas le plus simple est celui du chlore: de n° atomique 17 (17 protons), il est présent dans la nature sous la forme de 25% de chlore 37 (20 neutrons) et 75% de chlore 35 (18 neutrons). En faisant la moyenne à partir de ces proportions, la masse atomique de l'élément chlore devient ainsi [(37 x 0,25) + (35 x 0,75)], soit 35,5
3) Clarke d'un élément:
Cette notion permet de caractériser la fréquence de chaque élément dans la croûte terrestre. Pour les éléments les plus communs, on l'exprimera en pourcentage, tandis qu'on utilisera pour les autres le gramme/tonne, voire le milligramme/tonne pour les éléments les plus rares.
Exemples de clarkes:
- Aluminium: 8,2%, soit 82 kg/tonne
- Titane: 0,57%, soit 5.700 g/t
- Strontium: 375 g/t
- Scandium: 22 g/t
- Thallium: 0,45 g/t
- Sélénium: 0,09 g/t, soit 90 mg/t
- Tellure: 0,002 g/t, soit 2 mg/t
Il faut souligner le fait que ces moyennes ne sont que des valeurs statistiques, pour le calcul desquelles il est tenu compte de toutes les roches de l'écorce terrestre (granites, basaltes, marnes, calcaires,...). Il sera donc utile aussi de disposer des clarkes de chaque élément pour chaque type de roche- Par comparaison avec ces références, on pourra ultérieurement repérer les anomalies géochimiques, et en tirer des informations importantes sur la genèse des roches étudiées, voire même lancer des prospections minières.
Exemple: variations du clarke du cuivre dans différentes roches:
basaltes: 100 g/t
roches ultra-basiques: 10 g/t
météorites ferro-nickel: 172 g/t
Granites non calciques : 10 g/t
Argiles : 68 g/t
Calcaires : 20 g/t
Grès: 2 g/t
4) Classification des éléments:
Depuis les débuts de la chimie, de nombreux savants ont tenté de proposer une logique de classement des différents corps connus. Il a cependant fallu attendre 1869 et les travaux du chimiste russe Mendeleiev, pour disposer enfin d'un système cohérent et logique, qui n'a subi que peu de modifications depuis cette époque.
En ordonnant les éléments par ordre de masse atomique croissante, Mendeleiev constata que certaines propriétés chimiques se retrouvaient régulièrement. Il établit donc un tableau regroupant les éléments ayant le même comportement chimique. Bien que comportant à l'origine quelques erreurs et omissions, ce tableau sert toujours de trame à la classification en vigueur actuellement.
Il faut signaler que grâce à ce tableau, Mendeleiev a pu prévoir non seulement l'existence, mais également les propriétés, d'éléments non encore découverts à cette époque, alors que l'on ignorait encore tout de la structure atomique, des électrons, etc....
5) Tableau périodique de Mendeleiev:
Vous trouverez en annexe de votre revue préférée un tableau de classification périodique des éléments, présenté sous sa forme la plus facile à utiliser. Selon les besoins, on peut en effet faire varier le nombre de colonnes, et on peut également faire figurer pour chaque élément autant de données que l'on veut. Certains tableaux "complets" peuvent ainsi indiquer dans chaque case les points de fusion et d'ébullition, le rayon atomique, le nombre d'isotopes connus, le système cristallin, la densité, etc...
Ici, je me suis limité volontairement au symbole chimique et au numéro atomique de l'élément. Si le sujet vous passionne, tout libraire compétent doit pouvoir vous fournir un tableau plus complet.
a) Principe du tableau:
En parcourant le tableau de gauche à droite, et de haut en bas, on va vers des éléments à numéro atomique croissant.
A chaque ligne correspond un niveau d'énergie électronique, tandis que les colonnes indiquent le remplissage du niveau.
Une petite réserve, cependant: à partir du troisième niveau, le remplissage devient de plus en plus complexe, les niveaux se divisant en plusieurs sous-niveaux d'énergie voisine. Le remplissage d'un niveau électronique peut dans ces conditions commencer, alors que le niveau inferieur n'est pas encore plein, contrairement à ce que j'ai écrit dans l'article n°1.
J'admets le peu d'élégance du procédé, mais il faut bien avancer par étapes.
Donc, pour affiner un peu, il faudra dire que les propriétés chimiques d'un élément dépendent du remplissage du niveau électronique supérieur pour les éléments des colonnes IA à VIIIA (les plus "hautes"), et du remplissage des niveaux électroniques supérieurs pour les éléments des colonnes IIIB à IIB (les moins "hautes"). Par suite, des éléments situés dans une même colonne auront donc un remplissage identique de leurs niveaux électroniques supérieurs.
Selon ce principe, et pour réduire le nombre de colonnes, on a regroupé dans les mêmes cases certains éléments très semblables, à savoir les lanthanides, du groupe du lanthane, encore appelés "terres rares" (les amateurs de Trimouns doivent connaître...), et les actinides, du groupe de I'actinium.
Il faut noter également que tous les éléments situés au delà de l'uranium, dits "transuraniens", n'existent plus à l'état naturel, et ont été recréés artificiellement. Il en est de même du technétium (n°43) du prométhéum (n°61) et de l'astate (n°85), ce dernier est néanmoins présent dans les minerais d'uranium et de thorium, mais en proportions si infime que sa quantité totale sur Terre est estimée à environ 30 grammes !
b) Utilité de cette classification:
Même si l'on n'est pas féru de chimie, un petit coup d'œil nous permet déjà de constater et d'expliquer certains faits. On s'aperçoit ainsi que le phosphore et l'arsenic sont dans une même colonne (phosphates et arséniates: classe VII des minéraux), ainsi que le fluor, le chlore, le brome et l'iode (fluorures, chlorures, bromures, iodures: classe III).
On remarque aussi, sans que ce soit une règle absolue, que les éléments pouvant se remplacer facilement l'un l'autre au sein d'un minéral pour former éventuellement une série, sont souvent soit dans une même colonne (Ca et Mg, Nb et T4 Zr et Hf,...), soit immédiatement voisins sur une même ligne (Mn et Fe, Cu et Zn, Os et Ir,...). Explications: dans le premier cas, le remplacement est rendu possible par la similitude entre les niveaux électroniques supérieurs. Dans le deuxième cas, ces niveaux sont légèrement différents, mais le remplacement est facilité par le fait que ces éléments ont des rayons atomiques quasiment identiques, et qu'ils pourront donc s'intégrer dans le réseau moléculaire existant sans le déformer.
On notera que les éléments de la colonne VIIIA nous sont inconnus, à nous autres, minéralogistes.
Explication: leur niveau d'énergie externe est complet, avec huit électrons. Ils sont donc très stables, n'ont aucune affinité avec les autres éléments, et ne se combinent à aucun d'entre eux. On les appelle les "gaz inertes", ou encore "gaz rares". Ils sont présents en faibles quantités dans l'atmosphère terrestre.
Le seul que nous soyons amenés à fréquenter à l'occasion est le radon, qui est un gaz radioactif produit par la désintégration de l'uranium naturel. Son accumulation dans les habitations en granite et dans la collection de J.-C. L. en fait l'une des principales sources de pollution par radioactivité domestique. De même, il constitue le principal risque radioactif dans les mines d'uranium, ce qui oblige à ventiler fortement ces exploitations.Cela dit, je suis bien obligé de reconnaître que le tableau de Mendeleiev n'explique pas tout, ou plus exactement, ne m'explique pas tout. Ainsi, on me demande pourquoi des éléments au chimisme aussi différent que le carbone, le silicium, le germanium, l'étain et le plomb, se retrouvent dans une même colonne. On peut se poser la même question pour le cuivre et l'or, le premier se combinant très facilement à un grand nombre d'éléments, et le second très difficilement, et à très peu d'éléments.
On me demande également pourquoi le technétium n'existe qu'en tant que produit de synthèse, et comment Mendeleiev a fait pour classer les éléments par masse atomique croissante, sans connaître l'existence du proton et du neutron....
J’aime avoir affaire à des lecteurs attentifs.J'avais pourtant prévenu dès le début que je ne pourrais peut-être pas répondre à toutes les questions.Cependant, je ne me défile pas. Je demanderai seulement un léger sursis, le temps de trouver un peu de documentation sur le sujet.Cela dit, que ces quelques lacunes ne vous perturbent pas trop. Considérez que ce qui précède est non seulement exact, mais également bien suffisant pour le minéralogiste amateur moyen. Les précisions ne seront qu'un bonus destiné à récompenser votre curiosité intellectuelle.
Leçon n° 3: LES MOLECULES
Si vous avez eut l'immense bonheur de lire les deux leçons précédentes, vous vous rappelez certainement que les propriétés chimiques des éléments sont déterminées par leurs niveaux électroniques supérieurs.
On appelle "propriétés chimiques d'un élément "la manière dont les atomes de cet élément vont se lier entre eux et avec les atomes des autres éléments, pour constituer des molécules.
1) Notions de base:
Une molécule est électriquement neutre
Une molécule peut être constituée d’atomes identiques ou différents.
Une molécule est généralement composée d’un nombre assez petit d'atomes. Elle peut même être constituée d'un seul atome (molécule monoatomique). C'est le cas des gaz rares (voir leçon n°2), et de certains métaux à l'état gazeux.
Cependant, le nombre d’atomes d’une molécule n'est absolument pas limité, et certaines peuvent être formées de plusieurs milliers d'atomes (chaînes de polymères, A.D.N.,...), mais nous n'en aurons pas l'utilité ici.
Une molécule a une forme géométrique précise, et les molécules d'un même composé se disposent en fonction de cette géométrie de base pour constituer un réseau cristallin.
2) Corps purs, mélanges:
- Corps pur:
Définition : Un corps pur est constitué de molécules toutes identiques. Au sein des corps purs, on distinguera cependant les corps simples et les corps composés.
Un corps simple est composé de molécules identiques, elles-mêmes constituées d'atomes appartenant tous au même élément.
Exemple : Le gaz oxygène que nous respirons un peu partout, et en particulier en Auvergne, est constitué non pas d'atomes d'oxygène isolés, mais de molécules formées de deux atomes d'oxygène. Il faut d'ailleurs noter qu'on devrait alors parler de "dioxygène": c'est en effet le nom chimiquement correct de cette molécule, le terme "oxygène" étant réservé pour désigner l'élément. Cependant, par abus de langage et par commodité, on emploiera le mot "oxygène" pour désigner le gaz, et l'atome sera appelé "élément oxygène".
Un corps composé est un corps formé de molécules identiques, mais constituées d'atomes différents.
Exemple : Le gaz carbonique que l'on respire en région parisienne est constitué de molécules formées d'un atome de carbone et de deux atomes d'oxygène.
b) Mélanges:
Définition : Un mélange est un corps constitué d'au-moins deux sortes de molécules.
Exemple : L'atmosphère dans laquelle on tente péniblement de survivre à 18 h Place de la Concorde, est un mélange à la composition et à la toxicité fluctuantes, constitué de molécules aussi diverses que le gazole brûlé, le gazole non brûlé, l'ammoniac, le dioxyde de soufre, le monoxyde de carbone, le dioxyde d'azote, la nicotine, l'ozone, l'alcool éthylique, la dioxine, l'eau de Cologne plus ou moins bon marché, le désodorisant inefficace car il est plus de 17 h, et quelques traces de vaccin antigrippe à l'automne. On y détecte occasionnellement de faibles pourcentages d'oxygène les jours de grève des taxis.
Il va de soi qu'en minéralogie, nous nous intéresserons surtout aux corps composés. Les corps simples seront représentés par la classe I (éléments à l'état natif), et les mélanges seront les termes de passage entre des espèces bien définies (exemple: les intermédiaires de la série pyromorphite - mimétite), ou les minéraux dont la composition est variable.
3) Les différentes liaisons entre les atomes:
Au sein des molécules, les atomes sont reliés entre eux par différentes forces, et malheureusement pour vous, il est absolument nécessaire que nous y jetions un coup d'œil.
Ces forces sont au nombre de cinq, mais je ne m'étendrai que sur les deux premières, les trois autres étant moins importantes.
a) La liaison covalente:
Définition : Une liaison covalente est constituée pal la mise en commun d'une ou plusieurs paires d'électrons provenant des niveaux électroniques supérieurs de deux atomes (à savoir par cœur).
Exemple simple : la molécule du gaz hydrogène est composée de deux atomes d’hydrogène solidement attachés ensemble, cette forme étant plus stable que les atomes isolés d'hydrogène.
Explication : Chaque atome d'hydrogène possède un seul électron sur son niveau externe, qui peut toutefois en contenir deux (1er niveau d'énergie, voir leçon n°1). Deux atomes entrant en contact vont mettre en commun chacun un électron, soit deux en tout, c'est-à-dire une paire. Ces deux électrons vont alors orbiter indifféremment autour de l'un ou l'autre de ces deux atomes (voir schéma). Il y aura donc deux électrons sur leurs niveaux externes, qui seront ainsi complets.
Deux atomes réunis par une liaison covalente ont toujours leurs niveaux d'énergie externes complets (deux électrons pour l'hydrogène, et huit électrons pour tous les autres éléments). C'est la "règle de l'octet".
Ce point explique la solidité de ces liaisons, et la grande stabilité des corps ainsi constitués.
Autre exemple : un peu plus compliqué : La molécule de gaz carbonique (dioxyde de carbone) est composée d'un atome de carbone, et de deux atomes d'oxygène. L'atome de carbone possède quatre électrons sur son niveau externe, et les atomes d'oxygène en ont six. Il leur en manque donc respectivement quatre et deux pour être complets.
Le carbone va fournir deux électrons à chaque atome d'oxygène, et ces derniers vont fournir chacun deux électrons à l'atome de carbone. Il y aura donc quatre électrons (deux paires) mis en commun dans chaque liaison, soit huit électrons en en tout dans la molécule. Chaque atome aura bien alors huit électrons sur son niveau externe, selon la "règle de l'octet", et ainsi que le prouve le magistral schéma de la figure 2 (pour l'aspirine, j'avais prévenu).
Chaque liaison étant constituée de deux paires d'électrons, on emploiera le terme de liaison covalente double.
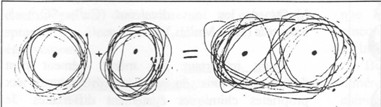
Figure 1 : Atomes et molécules d'hydrogène
De même, dans le cas d'une liaison mettant en commun trois paires d'électrons, on parlera de liaison covalente triple.
b) La liaison ionique :
Définition d'un ion : Un ion est un atome ou un groupe d'atomes ayant cédé ou reçu un ou plusieurs électrons. (à savoir par cœur).
Les électrons étant des charges négatives, l'ion présentera une surcharge positive ou négative selon qu'il aura perdu ou gagné ces électrons.
De plus, nous avons vu brièvement dans un chapitre précédent que les charges de signes opposés s'attiraient. Si l’on plonge dans une solution ionique une électrode de signe positif (anode) et une électrode de signe négatif (cathode), les ions négatifs seront attirés par la première, tandis que les ions positifs iront vers la seconde. En conséquence, les ions négatifs seront appelés anions (attirés par l'anode), tandis que les ions positifs seront appelés cations (attirés par la cathode). Ceci est également à savoir par cœur …
C'est cette attraction électrostatique qui fait que des ions de signes opposés vont s'attirer et se lier fortement l'un à l'autre, par ce que l'on nommera une liaison ionique.
Exemple simple: C'est celui du chlorure de sodium, mieux connu sous le nom de sel de cuisine, et qui est décrit dans tous les bons manuels de chimie, en raison justement de sa simplicité.

Figure 2- Atomes de carbone et d'hydrogène et molécule de gaz carbonique.
(rappel: les électrons ne sont pas "figés", mais en mouvement désordonné comme dans la Figure 1)
L'atome de sodium perd facilement un électron, pour donner un ion positif (déficit de 1 charge négative).
L'atome de chlore gagne facilement un électron. pour donner un ion négatif (excès de 1 charge négative).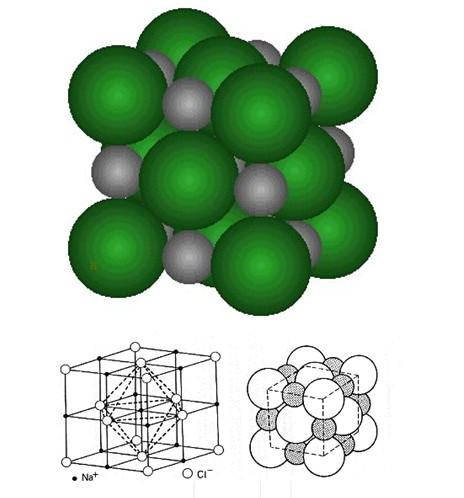
Figure 3 : Cristal de chlorure de sodium montrant l'alternance des atomes de chlore et de sodium.
Ces deux ions s'attirent donc, et se collent fortement l'un à l'autre. La répétition de cette opération produit un cristal cubique de chlorure de sodium.
Point important: Bien que composé de particules chargées électriquement, la charge globale du cristal est nulle: les charges positives et négatives étant présentes en mêmes quantités, elles s'équilibrent mutuellement.
Autre exemple moins facile:
Le fluor, comme le chlore, gagne facilement un électron (une charge négative en excès). Le calcium cède facilement deux électrons (déficit de deux charges négatives). Pour que l'équilibre final du cristal soit réalisé, chaque ion calcium doit donc se lier à deux ions fluor, et le composé ainsi formé contiendra alors deux fois plus de fluor que de calcium. Sa formule s'écrira bien sûr CaF2, et malgré cette description inhabituelle, je ne doute pas que vous aviez tous reconnu la fluorine.
Cependant, un composé ionique n'est pas toujours cubique. Nous n'avons vu ici que des exemples simples, et certains composés ont des structures plus complexes, en particuliers ceux contenant des ions constitués de plusieurs atomes (sulfates, phosphates, uranyles...).
Notion de valence:
On appelle valence (ou électrovalence) la charge électrique positive ou négative portée par un ion. Selon le nombre de charges excédentaires, on distinguera les ions monovalents, c'est-à-dire ayant une seule charge excédentaire (K+, Na+, CL-, MnO4-,...), les ions divalents (Cu2+, SO42-,....), trivalents (Al3+, Mn3+,...), etc...
Point important: Un même élément peut donner des ions de valences différentes, aux propriétés chimiques également différentes. Je citerai encore une fois un exemple classique des manuels de chimie, mais particulièrement parlant, à savoir le fer.
Celui-ci se présente dans la nature sous la forme d'ions divalents Fe2+ (fer ferreux), et d'ions trivalents Fe3+ (fer ferrique). Leurs valences étant différentes, leurs proportions dans un "même" composé seront différentes.
Exemple des sulfates de fer:
Sulfate ferreux: L'ion sulfate est divalent (SO42-), et l'ion ferreux aussi. Les deux ions seront donc présents en nombres équivalents, et la formule sera Fe(SO4).
Sulfate ferrique: L'ion ferrique étant trivalent (Fe3+), il en faudra deux pour équilibrer trois ions (SO42-), (car 3 x 2 = 6...). Dans ce cas, la formule chimique s'écrira Fe2(SO4)3.
Par suite, leurs réactions avec de nombreux produits chimiques seront différentes, notamment avec les acides.
Autres différences de propriétés: les composés ferreux sont moins stables, et ils s'oxydent facilement pour donner des composés ferriques.
Leur couleur est un critère assez fiable (mais non absolu) pour les distinguer: les composés ferriques sont plutôt de teinte brune, jaune, ou rougeâtre (goethite, laueite,...), alors que les composés ferreux présentent généralement des tons vert d'eau plus ou moins foncés (symplésite, mélantérite,...).
Chapitre important: En fait, dans les cristaux, les liaisons sont rarement purement ioniques ou purement covalentes. C'est la plupart du temps un "panaché" des deux, avec une prépondérance plus ou moins marquée de l'un ou l'autre de ces caractères, y compris dans tous les exemples que nous avons vus depuis le début. Je sais, c'est énervant, mais si j'avais écrit ça dès le début, vous n'auriez jamais lu la suite, et avouez que c'eut été dommage.
Pour achever les agonisants, je terminerai en vous révélant que le pourcentage de liaisons ionique et covalente dépend de la "différence entre les électronégativités respectives de chaque atome". Plus cette différence est forte, plus le caractère ionique de la liaison est marqué, et réciproquement (je crois utile et charitable de préciser que l’électronégativité d'un atome est sa capacité à capturer les électrons, et donc à se charger négativement).
c) Autres types de liaisons:
Nous en avons étudié deux, il en reste donc trois, qui bien que jouant un rôle mineur en minéralogie, doivent malgré tout être décrites sommairement.
La liaison métallique:
Dans les métaux, une partie des électrons de surface de chaque atome se libère facilement, et ces atomes vont alors se comporter comme des ions positifs entourés d'un nuage d'électrons libres passant indifféremment de l'un à l'autre. L'attraction entre les ions positifs et le nuage électronique négatif va alors assurer la cohésion de l'ensemble: c'est la liaison métallique.
Notons au passage que la forte conductibilité électrique des métaux est due justement à la présence de ces électrons non rattachés à un atome donné, et pouvant circuler librement. Le courant électrique étant, comme chacun ne le sait pas forcément, un déplacement d'électrons au sein de la matière.
La liaison de type "Van Der Waals":
Personnellement, et en toute humilité, je ne comprends rien à ce type de liaison, et ça ne m'a jamais empêché de pratiquer ma passion préférée. Mais je vous en parle quand même, d'abord par honnêteté intellectuelle, ensuite parce qu'elle joue quand même un rôle important dans certains minéraux.
Il s'agit, je cite, d'une "interaction dipolaire permanente induite entre les atomes". Cette force est beaucoup moins intense que les liaisons covalente ou ionique, et participe peu à la cohésion des cristaux. C'est elle, cependant, qui assure les faibles liaisons entre les feuillets silicatés du talc et de la pyrophyllite, par exemple.
La liaison hydrogène:
Elle est ainsi nommée car dans ce cas, c'est un atome d'hydrogène qui sert de "pont" entre deux atomes fortement électronégatifs (exemples: fluor, azote, oxygène,...). Cette liaison est plus forte que la liaison de Van Der Waals, mais bien plus faible que les liaisons ionique ou covalente. On la rencontrera par exemple dans le diaspore (AlOOH) ou la goethite (FeOOH).
Bien que ne jouant pas un rôle majeur en mineralogie, elle est extrêmement importante en chimie organique.
4) Conclusion:
J'ai hésité longuement avant de vous livrer ce cours en une seule fois. Il y avait en effet pas mal de notions ardues, mais j'ai finalement estimé qu'il valait mieux avaler d'un coup toute cette partie sur les liaisons intramoléculaires.
Cela dit, vous n'êtes pas obligés de tout retenir à la première lecture, mais n'hésitez pas à y revenir de temps en temps, et pour compléter, trouvez-vous, comme je le disais à la leçon n°1, un ou deux petits manuels d'occasion.
Le but de ce chapitre était d'abord de vous montrer que la matière ne s'empile pas en vrac comme des billes dans un sac, mais se combine sous l'action de forces et selon des règles bien précises. Mais vous l'aviez sans doute déjà intuitivement deviné en admirant sous votre bino la perfection de certains cristaux.
Ensuite, nous avons entrevu que ces règles précises font que les molécules et les ions ont des propriétés chimiques également bien déterminées. La mise en évidence de ces propriétés par des expériences parfois d'une simplicité enfantine permet d'identifier les ions présents, ainsi que le minéral les contenant.
Et voilà. Votre patience et votre courage vont être aujourd'hui récompensés. Après avoir étudié les orbitales électroniques, les molécules, les neutrons, les ions, les interactions, les attractions, et autres répulsions, nous entrons enfin dans un chapitre qui vous servira pratiquement tous les jours. Ne regrettez pas vos efforts, ils étaient indispensables pour bien comprendre ce qui va suivre.
Leçon n°4 : LES FORMULES CHIMIQUES
1) Quelques petits rappels :
*Une molécule est constituée d'atomes d'un ou de plusieurs éléments.
*A chaque élément est attribué un symbole universel, composé d'une lettre capitale suivie ou non d'une lettre minuscule.
*Un ion est un atome ou un groupe d'atomes ayant gagné ou perdu un ou plusieurs électrons (ceci était à apprendre par cœur dans le chapitre précédent, et je n'imagine pas un seul instant que mon conseil ait pu ne pas avoir été suivi. Je répète simplement la formule au cas où il y aurait de nouveaux lecteurs...).
2) Principe de la formule chimique :
Le principal intérêt de la formule chimique d'un corps est d'indiquer les éléments présents dans celui-ci, leurs proportions respectives, et, éventuellement, leur organisation, ainsi que l'état dans lequel se trouvent certains de ces éléments.
Si le composé est moléculaire, la formule chimique indiquera les éléments constituant chaque molécule. Si le composé est ionique, ou comporte de nombreuses liaisons métalliques, la formule indiquera les éléments contenus dans une quantité donnée de matière,
On utilisera pour cela non seulement les symboles des éléments, bien sûr, mais également des chiffres, des opérateurs, des signes de ponctuation, des lettres grecques, des crochets et des parenthèses.
Nous allons progresser au moyen d'exemples de plus en plus complexes, jusqu'à vous donner une maîtrise telle que le Fleischer deviendra votre livre de chevet. C'est d'ailleurs de ce dernier que sont extraites les formules chimiques ayant servi à illustrer mon propos.
1er exemple (gentil) :
La millerite est composée de soufre et de nickel. Plus exactement, c'est un sulfure de nickel dans lequel ces deux éléments sont en proportions équivalentes, c'est à dire que pour un atome de nickel (symbole Ni), il y a un atome de soufre (symbole S). La formule chimique s'écrira donc tout bêtement : NiS
et jusque là, ça doit aller.
Si par hasard ça n'allait pas, revoyez d'urgence les 3 chapitres précédents avant de continuer celui-ci.
2ème exemple (presque aussi gentil !) :
La vaesite est également un sulfure de nickel, mais elle contient deux fois plus de soufre que de nickel, c'est à dire que pour un atome de nickel, il y a maintenant deux atomes de soufre. Il est indispensable que cette différence par rapport à la millerite apparaisse dans la formule chimique, et il faudra donc écrire : NiS2
et ça doit toujours aller.
1ère règle :
un chiffre placé en indice derrière le symbole d'un élément indique le nombre d'atomes de cet élément présents dans une molécule du composé.
Autres formules simples établies selon la première règle :
Pyrite : 1 atome de fer, 2 de soufre FeS2
Hématite: 2 atomes de fer, 3 d'oxygène Fe2O3
Magnétite : 3 atomes de fer, 4 d'oxygène : Fe3O4
Uraninite : 1 atome d'uranium, 2 d'oxygène UO2
Hedleyite : 7 atomes de bismuth, 3 de tellure Bi7Te3
Quartz : 1 atome de silicium, 2 atomes d'oxygène SiO2
(NB : s'il y a un seul atome d’un élément, on n'écrit aucun nombre en indice derrière celui-ci)
3ème exemple :
Selon cette première règle, même les plus dissipés d'entre vous déduiront aisément que la carrollite, constituée de quatre atomes de soufre, un de cuivre et deux de cobalt, a pour formule chimique : CuCo2S4
Autres formules d'écriture semblable :
Chalcopyrite : CuFeS2 (1 atome de cuivre, 1 de fer, 2 de soufre)
Bornite : Cu5FeS4 (5 de cuivre, 1 de fer, 4 de soufre)
Stannite : Cu2FeSnS4 (2 cuivre, 1 fer, 1 étain. 4 soufre)
Calcite : CaCO3 (1 calcium, 1 carbone, 3 oxygène)
ChrysobéryI : BeAl2O4 (1 béryllium, 2 aluminium, 4 oxygène)
Cryolite: Na3AIF6 (3 sodium, 1 aluminium, 6 fluor)
4ème exemple :
Au sein d'un composé, il peut parfois se trouver un groupe d'atomes ayant des propriétés particulières, et qu'il faudra distinguer du reste de la formule au moyen de parenthèses. Celles-ci sont essentiellement utilisées dans deux cas, soit pour mettre en évidence un ion polyatomique, soit pour isoler une part variable de la formule.
Ainsi, nous avons vu ci-dessus Ia formule de la calcite écrite CaCO3. Ce n'est pas faux, mais en fait, la calcite est un composé ionique, formé d'ions
calciums Ca2+ et d'ions carbonates (CO3)2- (en nombre équivalent, car tous les deux divalents, voir leçon précédente). On pourra donc préciser sa formule chimique en l'écrivant sous la forme : Ca(CO3)
Ce n'est certes pas indispensable dans le cas de la calcite, l'ion carbonate étant facile à identifier même s'il n'est pas entre parenthèses. Mais ces dernières seront très utiles dans le cas de minéraux comportant plusieurs ions différents. Le chiffre éventuellement placé en indice après la parenthèse de fermeture indiquera, comme pour les éléments isolés, le nombre d'ions présents dans la molécule.
Prenons l'exemple de la beudantite : dans l'absolu, si l'on se contente de signaler les éléments présents, sa formule est: : bFe3AsSO14H6
En fait, elle comprend des ions sulfates (SO4)2-, des ions arséniates (As04)2-, et des ions hydroxyles (OH)-. Il sera donc plus correct d'écrire : PbFe3(AsO4)(S04)(OH)6
et le caractère de ce minéral, intermédiaire entre les groupes des sulfates et des arséniates, est alors clairement mis en évidence.
Autres exemples de minéraux comportant plusieurs anions dans leur formule chimique:
Tychite : Na6Mg2(CO3)4(SO4) (ions carbonate et sulfate)
Malachite: Cu2(CO3)(OH)2 (ions carbonate et hydroxyle)
Susannite: Pb4(SO4)(CO3)2(OH)2 (ions sulfate, carbonate, hydroxyle)
Salesite : Cu(IO3)(OH) (ions iodate et hydroxyle)
Dietzeite : Ca2(IO3)2(CrO4) (ions iodate et chromate)
5ème exemple :
Les parenthèses servent également, comme je l'ai brièvement signalé tout à l'heure, à isoler une part variable de la formule chimique.
Ainsi, la bravoite (variété) est un sulfure de fer et de nickel, de composition intermédiaire entre la vaesite (NiS2) et la pyrite (FeS2). Les proportions de fer et de nickel dans la bravoite ne sont pas fixes, mais au final, il doit y avoir deux atomes de soufre pour un atome métallique. La formule chimique s'écrira donc : (Ni, Fe)S2
et ce sont les parenthèses et la virgule qui indiqueront que Ni et Fe sont présents tous les deux, mais que leur proportion totale doit être égale à la moitié de celle du soufre.
Si l'on veut établir la formule réelle d'un échantillon donné de bravoite, il faudra recourir à une analyse quantitative. Ainsi, une bravoite composée de 4/10èmes de vaesite et de 6/10ème de pyrite aura pour formule : Ni0.4Fe0.6S2
et les parenthèses ne sont alors plus nécessaires.
6ème exemple :
La part variable d'une formule chimique peut comporter bien plus de deux éléments, et plusieurs parties d'une même formule peuvent être variables. Ainsi l'aeschynite-(Ce) a pour formule : (Ce,Ca,Fe,Th)(Ti,Nb)2(O,OH)6
Cela signifie que la proportion totale de cérium, calcium, fer et thorium doit être de 1 pour 2 parts de titane et de niobium, et 6 parts d'oxygène et d'hydroxyle. Une aeschynite-(Ce) pourra par exemple avoir pour formule: e0.15Ca0.24Fe0.36Th0.25Ti1.6Nb0.4(O,OH)6
et les chipoteurs et les incrédules pourront vérifier que (0,15 + 0,24 + 0,36 + 0,25 = 1), et (1,6 + 0,4 = 2). Pour ne pas compliquer, on laisse entre parenthèses la partie oxydée de la formule : les proportions de O2- et (OH)- sont en effet conditionnées par les proportions respectives des différents éléments métalliques, afin de conserver la neutralité électrique de l'ensemble.
7ème exemple :
La part variable de la formule peut également être la partie anionique de la formule. Ainsi, la carbonate-fluorapatite a pour formule dans le Fleischer Ca5(PO4,CO3)3F. Pour cinq atomes de calcium, il y aura donc 3 anions (PO4)2- et (CO3)2-, et un ion fluorure. Un minéral dont l'analyse établirait qu'il a pour formule celle donnée ci-dessous, serait bien une carbonate-fluorapatite : a5(PO4)1.35(CO3)1.65F
Autres exemples de minéraux à formule plus ou moins variable :
Césium-kupletskite : (Cs,K,Na)3(Mn,Fe)7(Ti,Nb)2Si8O24(O,OH,F)7
Braggite : (Pt,Pd,Ni)S
Rusakovite : (Fe,Al)5(VO4,PO4)2(OH)9.3H2O
Romeite : (Ca,Fe,Mn,Na)2(Sb,Ti)2O6(O,OH,F)
8ème exemple :
Les observateurs attentifs auront remarqué ci-dessus, dans la formule de la rusakovite, une partie séparée du reste de la formule par un point. Un compose peut en effet contenir de l'eau (et parfois d'autres produits) sous forme moléculaire. Occupant des sites interstitiels au sein du réseau cristallin, cette eau doit apparaître dans la formule, sans être décomposée en hydrogène et oxygène. De plus, le chiffre indiquant la quantité d'eau présente doit être placé avant H2O, car il s'agit d'une molécule et non plus d'éléments ou d'ions.
Les exemples sont abondants, des sulfates aux zéolites, en passant par les composés oxydés d'uranium.
Quelques-uns dans le désordre :
Gypse : Ca(SO4).2H2O
Natrolite : Na2Al2Si3O10.2H2O
Autunite : Ca(UO2)2(PO4)2.10-12H2O
Méta-autunite : Ca(UO2)2(PO4)2.2-6H2O
Dans les deux derniers cas, le trait d'union entre les nombres indiquant la quantité d'eau présente signifie bien sûr que celle-ci peut varier, par exemple de 10 à 12 molécules d'eau dans le cas de l'autunite.
2ème règle:
un chiffre placé devant la formule d'un composé indique dans quelles proportions celui-ci intervient dans la formule ou dans la réaction chimique.
9ème exemple :
Nous avons vu dans un précédent chapitre qu'un même élément pouvait parfois donner des ions de valences différentes. Nous avons étudié sommairement l'exemple du fer, de ses ions ferreux Fe2+, et de ses ions ferriques Fe3+. Nous avons insisté sur le fait que les propriétés chimiques de ces ions étaient différentes, et que par conséquent, les composés dans lesquels ils sont présents avaient des propriétés également différentes.
Ces différences devront, elles aussi, apparaître dans la formule chimique de ces corps, et on écrira par exemple ainsi la formule de la lausenite :
Fe23+(S04)3.6H20
Il est clair ainsi qu'il s'agit d'un composé ferrique, comportant deux ions Fe3+ pour trois ions (SO4)2-.
Voici encore quelques exemples de composés de ce type :
Lithiophilite : LiMn2+PO4
Delafossite : Cu+Fe3+O2
Uranosilite : U6+Si7O17
3ème règle :
un chiffre suivi de + ou -, et placé en exposant derrière un atome ou un groupe d'atomes, indique qu'il s'agit d’un ion et quelle est sa charge électronique.
10ème exemple :
Un minéral peut également comporter des ions différents d'un même élément, ce qui rend encore plus indispensable leur différenciation au sein de la formule chimique.
Ainsi, au début de mon exposé, je me suis permis d'écrire comme suit la formule de la magnétite : Fe304
En fait, il y a dans sa composition un ion ferreux et deux ions ferriques, pour quatre atomes d'oxygène. Sa formule correcte est donc : Fe2+Fe23+O4
Les éléments pouvant présenter plusieurs états ioniques sont très nombreux, mais certains ions n'apparaissent que rarement. Outre le fer, les plus fréquents sont le manganèse (Mn2+, Mn3+ et Mn4+), le cuivre (Cu2+ et Cu+), l'antimoine (Sb5+ et Sb3+), l'étain (Sn2+ et Sn4+), l'arsenic (As5+ et As3+), le vanadium (V4+ et V5+ ), etc...
Exemples de minéraux comportant des cations différents du même élément :
Cervantite : b3+Sb5+O4
Flinkite : Mn22+Mn3+(AsO4)(OH)4
Vanoxite : V44+V25+O13
11ème exemple :
Plusieurs minéraux peuvent avoir même composition chimique, mais différer par leur système cristallin.
La blossite et la ziesite sont deux oxydes de cuivre et de vanadium, de composition Cu22-V25'O7. Le premier est orthorhombique, tandis que le second est monoclinique. Pour marquer cette différence, on parlera de formes alpha et béta, et on écrira leurs formules comme suit.
Blossite : α-Cu22+V25+07
Ziesite : β-Cu22+V25+07
Notons quand même que le recours aux lettres grecques n'est pas systématique, et que les formules de nombreux minéraux di- ou trimorphes s'écrivent sans ces caractères.
12ème exemple :
La lettre x peut parfois être utilisée pour indiquer la quantité de tel ou tel élément dans une formule. Elle sert à définir une légère marge de variation d'un élément, le reste de la formule étant constant.
Ainsi, la pyrrhotite a pour formule : Fe1-xS (x = 0 - 0.17)
Le fer est donc présent dans ce minéral, en proportion de (1-x) pour 1 atome de soufre. "x" remplace une valeur variable et petite, qui indique que l'élément concerné est présent en proportion de 1, mais peut accuser un léger déficit. La valeur de x pourra être par exemple 0.1, ce qui donnera alors une pyrrhotite ayant pour formule : Fe0.9S
Les minéraux présentant cette particularité sont peu nombreux. En voici quelques-uns:
Gaudefroyite : Ca4Mn3-x3+(BO3)3(CO3)(O,OH)3
Plumbopyrochlore : (Pb,Y, U,Ca)2-xNb2O6(OH)
Morozeviczite: (Pb,Fe)3Ge1-xS4
13ème exemple :
Dans certains cas, la lettre x apparait en indice pour deux ou plusieurs termes de la formule chimique. Si la valeur de x augmente, les proportions de certains termes baissent, tandis que celles de certains autres augmentent, et réciproquement. Là encore, cette marge de variation reste, comme dans l'exemple précédent, relativement limitée. Ainsi, la hibschite, un membre peu courant du groupe des grenats, a pour formule :
Ca3Al2(SiO4)3-x(OH)4x (x= 0,2 - 1,5)
Cela signifie que dans la formule, la lettre x est une valeur comprise entre 0,2 et 1,5. Si par exemple x=0,8 - la formule devient
Ca3Al2(SiO4)3-0,8(OH)4.0,8
soit, plus simplement-
Ca3Al2(SiO4)2,2(OH)3,2
Les valeurs extrêmes de la formule de la hibschite sont donc
Ca3Al2(SiO4)2,8(OH)0,8
à
Ca3Al2(SiO4)1,5(OH)6
Les minéraux de ce type sont assez rares, mais un épluchage patient du Fleischer m'a cependant permis de vous en recenser quelques-uns:
Paraotwayite : Ni(OH)2-x(SO4,CO3)0,5x
(valeur de x sensiblement égale à 0,6)
Perroudite : Hg5-xAg4+xS5-x(CI,I,Br)4-x
Ralstonite : NaxMgxAl2-x(F,OH)6.H2O
Defernite : Ca6(CO3)2-x(SiO4)x(OH)7(Cl,OH)1-2x
Pour finir, vous trouverez ci-dessous une liste des principaux anions que vous rencontrerez dans les formules chimiques des minéraux. Ceci devrait vous permettre d'identifier vous-même la classe de chaque minéral.
N.B. : je fais suivre chaque anion de sa charge électronique, bien que celle-ci ne figure que rarement dans la formule chimique. Ceci afin de faire ressortir la différence entre certains ions assez semblables.
|
Br- |
Bromure |
|
Cl- |
Chlorure |
|
F- |
Fluorure |
|
I- |
Iodure |
|
O2- |
Oxyde |
|
(OH)- |
Hydroxyle |
|
(CO3)2- |
Carbonate |
|
(NO3) - |
Nitrate |
|
(BO3)2- |
Borate |
|
(BO4) 4- |
Borate |
|
(IO3) - |
Iodate |
|
(SO4) 2- |
Sulfate |
|
(SO3) 2- |
Sulfite |
|
(SeO4) 2- |
Séléniate |
|
(SeO3) 2- |
Sélénite |
|
(TeO4) 2- |
Tellurate |
|
(TeO3) 2- |
Tellurite |
|
(CrO4)2- |
Chromate |
|
(MoO4) 2- |
Molybdate |
|
(WO4) 2- |
Tungstate |
|
(PO4) 2- |
Phosphate |
|
(AsO4) 2- |
Arséniate |
|
(VO4) 2- |
Vanadate |
|
(AsO3) 3- |
Arsénite |
|
(SiO4) 4- |
Silicate |
Attention : dans le cas des silicates, l'ion (SiO4) 4- est présent sous cette forme uniquement chez les nésosilicates. Dans tous les autres, les tétraèdres (SiO4) mettent en commun un ou plusieurs atomes d'oxygène, et se groupent pour former des anneaux, des rubans, ou des chaînes. Ainsi, dans la famille des cyclosilicates, les groupes ainsi constitués auront pour formule (Si3O9)6-, (Si4O12)8-, ou (Si6O18)12-.
Je n'ai pas assez de place pour détailler ici la structure très complexe des silicates, et une fois de plus ça tombe bien, car je ne suis pas compétent. Pour plus d'information, je vous renverrai à des ouvrages plus complets, comme par exemple le livre de P. Bariand, F. Cesbron et J. Geffroy, "Les minéraux, leurs gisements, leurs associations", qui vient d'ailleurs d'être réédité par le B.R.G.M.. Cette fois, ne le ratez pas !
Voilà, vous savez maintenant le principal sur les formules chimiques, et vous avez gravi une nouvelle marche sur l'escalier abrupt de votre élévation personnelle, à laquelle je suis humblement fier d'apporter ma modeste contribution.
Mais au delà de ces petits traits d'humour que vous me pardonnerez, je suis conscient d'avoir bien besoin, moi aussi, de fignoler ma culture scientifique, et je dirais même que ça se voit.
C'est pourquoi un nouvel adhérent, Mr Guigner, physicien de métier et heureux possesseur de notions de chimie incomparablement plus solides que les miennes, m'a fait parvenir un courrier me signalant que mes précédents articles comportaient quelques erreurs et imprécisions regrettables, certes pas dramatiques, mais néanmoins inadmissibles dans un opuscule de cette tenue.
En préambule au prochain article, qui traitera des réactions chimiques, je rectifierai donc ces petites boulettes.
Et loin de me vexer, je tiens à remercier très sincèrement Mr Guigner pour ses critiques constructives, ceci d'autant plus que, en accord avec l'esprit associatif de I'A.F.M., il a bien voulu accepter de relire et de corriger mes écrits futurs avant leur publication dans le cahier. Il a d'ailleurs entamé cette lourde tâche en remettant un peu d'ordre et de rigueur scientifique dans le présent article
Un grand merci, donc, à lui et à tous ceux qui ont eu la bonté et le courage de me lire.


